Une randomisation intelligente et adaptative pour vos essais cliniques
Datacapt Randomization est un module flexible et puissant qui simplifie même les stratégies d’allocation les plus complexes, entièrement intégré au sein de Datacapt EDC.Avec une interface intuitive et une mise en place rapide, il offre à vos équipes le contrôle, la conformité et la rapidité dont elles ont besoin sans complexité.
.webp)
Rejoignez une puissante communauté qui favorise le changement grâce à Datacapt





Datacapt rend la randomisation fluide et naturelle dans vos workflows d’étude.
La randomisation, simplifiée
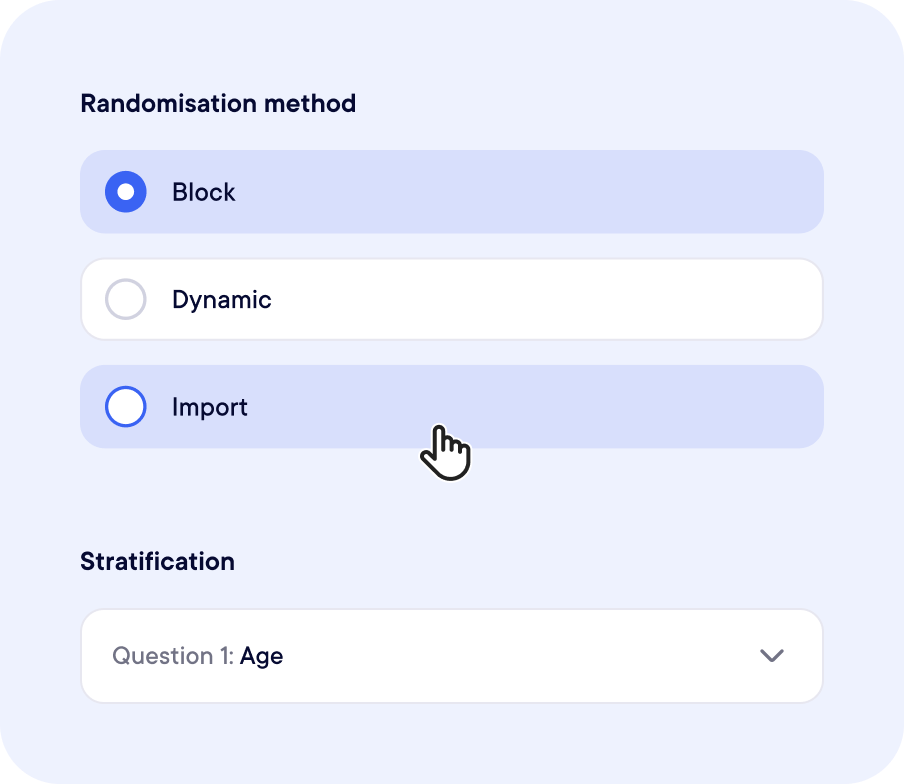
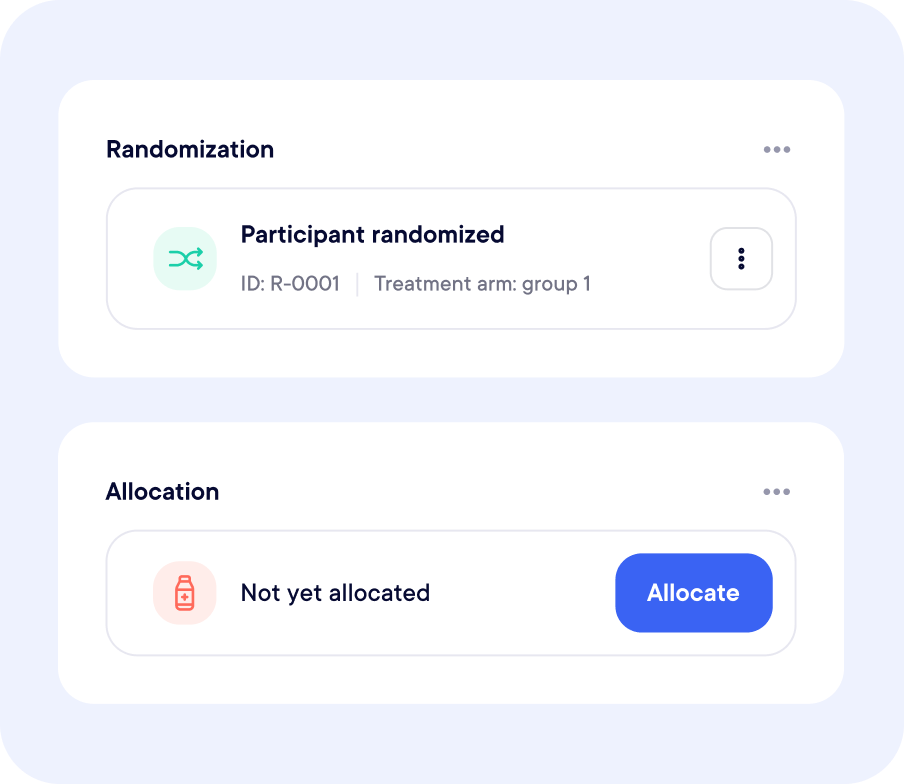
Entièrement intégré à votre workflow d’étude

Prêt à simplifier la randomisation ?
Demandez une démo et découvrez comment Datacapt intègre des stratégies d’allocation puissantes et conformes au protocole directement dans votre environnement d’étude sans complexité.
Questions fréquemment posées
Nous supportons la randomisation en blocs, stratifiée, dynamique (minimisation), et plus encore.
Oui. Toute la logique d’allocation est entièrement validée selon les lignes directrices GCP et 21 CFR Part 11. Nous supportons des méthodes avancées comme la minimisation de Pocock-Simon pour assurer un équilibre entre les bras de traitement, avec documentation complète, audit trail et processus conformes.
Oui. Notre module no-code permet d’appliquer des modifications (ex. ratio, strates) avec versionning et contrôle d’audit idéal pour les designs adaptatifs.
Oui. Les modules Randomisation et Supply Management sont reliés en temps réel pour éviter les erreurs et fluidifier la logistique.
Autre question ?
Nos clients sont nos meilleurs ambassadeurs
Découvrez pourquoi plus de 200 entreprises font confiance à Datacapt.







Pensé pour vos équipes.
Optimisé pour vos études.
Une expérience unique.
Blog & News Datacapt
Les derniers articles, guide et tutoriels.







.jpg)

